
Mol Cell | 揭示T细胞抗原受体信号多样性的脂质静电调控机制
T细胞作为适应性免疫的关键角色,其激活依赖T细胞受体(TCR)对递呈抗原的精准识别与信号传递。这一过程的异常不仅会导致免疫缺陷,还与肿瘤免疫逃逸、慢性感染中T细胞耗竭密切相关。长期以来,TCR信号如何实现“精准启动”与“功能多样性”一直是免疫领域的关键科学问题。作为抗原受体,TCR的核心功能在于将多样的胞外抗原刺激信号转化为胞内信号,从而指导精确的T细胞免疫程序。它由一个抗原识别亚基TCRαβ和三个信号亚基CD3εδ、CD3εγ和CD3ζζ构成,其中四种CD3信号链的胞内区共含有10个免疫受体酪氨酸活化基序(Immunoreceptor activation tyrosine-based motif, ITAM),即20个可磷酸化的酪氨酸位点。这些位点如何通过磷酸化组合产生特异性的抗原信号,仍然是免疫学中的未解之谜。近期,多项冷冻电镜研究报道了TCR-CD3复合体结构,然而CD3胞内信号区信息由于其无序性和高度动态性而缺失。因此,填补这一知识空白对于完整地理解抗原免疫应答至关重要。
2025年10月2日,中国科学院深圳先进技术研究院合成生物学研究所施小山课题组、中国科学院分子细胞科学卓越创新中心许琛琦课题组与上海科技大学王皞鹏课题组合作,在Molecular Cell杂志上发表了题为“Lipid-regulated phosphorylation hierarchy of the T cell receptor tyrosine motifs”的封面研究论文。该研究利用核磁共振、定量质谱和细胞实验,解析了TCR-CD3复合物中关键信号亚基CD3ζ的胞内区结构以及磷酸化规律,揭示了正电基序(Basic residue Rich Sequence, BRS)与脂质相互作用在其中的关键调控机制,同时提出CD3ζ磷酸化不充分是T细胞功能耗竭的诱因之一,为合成免疫受体的理性设计提供了新思路。
CD3ζζ同源二聚体是TCR-CD3复合物的主要信号亚基,每条CD3ζ的胞内区含有3个ITAM,由此贡献了TCR中60%的可磷酸化酪氨酸位点。CD3ζ胞内区一直被用作嵌合抗原受体(CAR)的固定模块,启动其信号级联反应。为攻克“无序且动态”的CD3ζ胞内区在结构解析上的技术难题,研究团队采用模拟生理膜酸性磷脂环境的脂质双分子层(bicelle)系统,结合溶液核磁共振(NMR)技术,成功解析了CD3ζ胞内信号区的动态结构。CD3ζ的3个ITAM基序呈现“N端到C端梯度膜插入”的异质性——N端的ITAM1膜插入程度最浅,中间的ITAM2膜插入程度居中,而C端的ITAM3膜插入程度最深。值得注意的是,ITAM的膜插入水平主要由其邻近的BRS与脂质的相互作用调控,而非由ITAM自身序列决定。这一发现明确了CD3ζ ITAM结构异质性的分子基础。
结构的异质性往往对应功能的特异性,研究团队进一步探究了ITAM膜插入差异对其磷酸化的影响。利用新型靶向定量质谱等技术,研究团队发现了脂质依赖的磷酸化顺序:在酸性脂质存在时,CD3ζ的3个ITAM呈现N端到C端的“顺序磷酸化”——ITAM1磷酸化最快,ITAM2次之,ITAM3最慢;而在中性脂质环境中,这种顺序性完全消失。这一结果表明,脂质通过调控ITAM的膜插入深度,直接决定了其被LCK激酶(TCR信号关键激酶)磷酸化的效率:膜插入浅的ITAM更易被激酶接触,磷酸化更快;反之则更慢。为进一步验证这一机制,研究团队突变了CD3ζ的BRS基序,破坏ITAM的膜插入梯度,磷酸化的顺序性也随之瓦解。这些结果证实了“BRS-lipid”的静电相互作用是CD3ζ顺序磷酸化的核心驱动因素。
TCR信号的精准调控不仅关乎生理免疫应答,更与病理状态(如肿瘤、慢性感染)下的T细胞耗竭密切相关。研究团队进一步探究了慢性TCR刺激(模拟肿瘤微环境或慢性感染)对CD3ζ磷酸化的影响。结果表明:T细胞在耗竭过程中CD3ζ的磷酸化模式发生显著改变——C端的ITAM3的磷酸化衰减速度远快于N端的ITAM1,这导致细胞中积累大量“部分磷酸化”的CD3ζ,进而引发TCR信号不足。慢性刺激过程中ATP耗竭是这一异常的关键原因,因为ATP不足使得膜插入程度高的酪氨酸不容易获得磷酸化。这一发现为T细胞耗竭机制提供了新解释:即除了免疫检查点分子(如PD-1、LAG3等)外,TCR自身的磷酸化不足也是T细胞功能异常的重要原因。在多种人类肿瘤中,T细胞耗竭与TCR信号不足具有明确的相关性。
综上所述,该研究通过生物物理学、生物化学和免疫学的多学科交叉,解析了CD3ζ胞内区在生理酸性膜环境中的动态结构,阐明了静电调控的ITAM的顺序磷酸化规律,发现了T细胞耗竭的新机制,为免疫治疗提供了新思路。
中国科学院深圳先进技术研究院合成生物学研究所施小山研究员、中国科学院分子细胞科学卓越创新中心许琛琦研究员以及上海科技大学王皞鹏研究员为该论文的共同通讯作者。分子细胞科学卓越创新中心李华副研究员、孟丽博士、深圳先进技术研究院褚纯博士、分子细胞科学卓越创新中心李昌庭、杨皓晨为该论文的共同第一作者。本研究获得了深圳合成生物研究重大科技基础设施和深圳合成生物学创新研究院公共技术平台提供的技术支持,特别是质谱平台在数据采集过程中的专业支撑。
该论文被选为封面故事:六孔长笛象征含六个酪氨酸磷酸化位点的CD3ζ。正如不同的笛子孔位组合可产生各种音调,不同的CD3ζ磷酸化组合也能产生多样化的信号输出,从而决定抗原免疫应答的特异性。封面插画由许琛琦课题组的张雨萌同学创作。

文章上线截图
原文链接:https://www.cell.com/molecular-cell/abstract/S1097-2765(25)00746-4
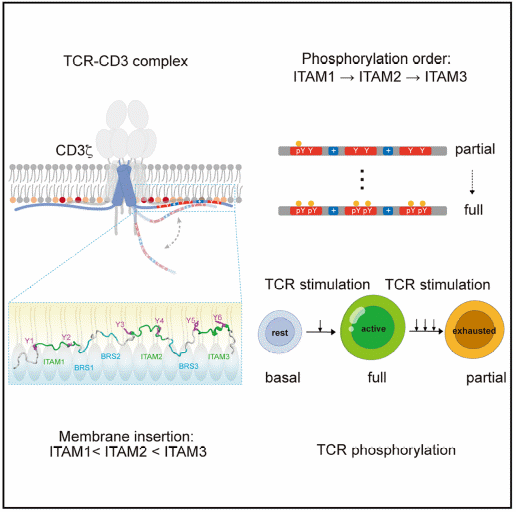
图1 CD3ζ信号区的膜结合结构及其磷酸化层级性

附件下载: